- Szerző Alex Aldridge [email protected].
- Public 2023-12-17 13:41.
- Utoljára módosítva 2025-06-01 07:36.
A legfontosabb különbség az első és a másodrendű reakciók között az, hogy az elsőrendű reakciók sebessége a reagens koncentrációjának első hatványától függ a sebességegyenletben, míg a másodrendű reakciók sebessége a koncentráció második hatványától függ kifejezés az árfolyamegyenletben.
A reakció sorrendje azoknak a hatványoknak az összege, amelyekre a reagenskoncentráció felemelkedik a sebességi törvény egyenletében. E meghatározás szerint a reakcióknak többféle formája létezik; nulladrendű reakciók (ezek a reakciók nem függnek a reagensek koncentrációjától), elsőrendű reakciók és másodrendű reakciók.
Mik azok az elsőrendű reakciók?
Az elsőrendű reakciók olyan kémiai reakciók, amelyeknél a reakció sebessége a reakcióban részt vevő egyik reagens moláris koncentrációjától függ. Ezért a reakció sorrendjének fenti definíciója szerint azoknak a hatványoknak az összege, amelyekre a reagenskoncentrációt a sebességi egyenletben emelik, mindig 1 lesz. Ezekben a reakciókban akár egyetlen reagens is részt vehet. Ezután a reagens koncentrációja határozza meg a reakció sebességét. De néha egynél több reagens vesz részt ezekben a reakciókban, akkor ezek közül az egyik reagens határozza meg a reakció sebességét.
Vegyünk egy példát a fogalom megértéséhez. Az N2O5 bomlási reakciójában NO2 és O keletkezik. 2 gázok termékként. Mivel csak egy reaktánsa van, a reakciót és a sebességi egyenletet a következőképpen írhatjuk fel.
2N2O5(g) → 4NO2(g) + O 2(g)
Arány=k[N2O5(g)]m
Itt k a reakció sebességi állandója, m pedig a reakció sorrendje. Ezért a kísérleti meghatározások alapján m értéke 1. Tehát ez egy elsőrendű reakció.
Mik azok a másodrendű reakciók?
A másodrendű reakciók olyan kémiai reakciók, amelyeknél a reakció sebessége a reakcióban részt vevő két reagens moláris koncentrációjától vagy az egyik reagens második hatványától függ. Ezért a reakció sorrendjének fenti definíciója szerint azoknak a hatványoknak az összege, amelyekre a reagenskoncentrációt a sebességi törvény egyenletében emeljük, mindig 2 lesz. Ha két reagens van, a reakció sebessége az első hatványtól függ. az egyes reagensek koncentrációjától.
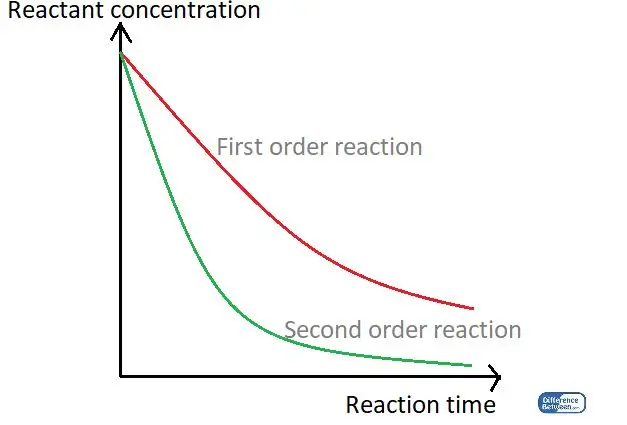
01. ábra: A reakció két típusát összehasonlító grafikon a reakcióidejük és a reagenskoncentráció alapján.
Ha egy reaktáns koncentrációját 2-szeresére növeljük (ha két reagens van a sebességegyenletben), akkor a reakció sebessége 4-szeresére nő. Vegyük például a következő reakciót.
2A → P
Itt A egy reagens, és P a termék. Ha ez egy másodrendű reakció, akkor ennek a reakciónak a sebességegyenlete a következő.
Arány=k[A]2
De két különböző reagenssel történő reakcióhoz, például az alábbiakhoz;
A + B → P
Arány=k[A]1[B]1
Mi a különbség az első és a másodrendű reakciók között?
Az elsőrendű reakciók olyan kémiai reakciók, amelyeknél a reakció sebessége a reakcióban részt vevő egyik reagens moláris koncentrációjától függ. Ezért, ha a reagens koncentrációját 2-szeresére növeljük, a reakció sebessége 2-szeresére nő. A másodrendű reakciók olyan kémiai reakciók, amelyekben a reakció sebessége két reagens moláris koncentrációjától vagy a reakcióban részt vevő egyik reagens második teljesítményétől függ. Tehát, ha a reagens koncentrációját 2-szeresére növeljük, a reakció sebessége négyszeresére nő. Az alábbi infografika táblázatos formában mutatja be az első és másodrendű reakciók közötti különbséget.

Összefoglaló - Első és másodrendű reakciók
A reakcióknak három fő típusa van a reakció sorrendje szerint; nulladrendű, elsőrendű és másodrendű reakciók. A legfontosabb különbség az első és a másodrendű reakciók között az, hogy az elsőrendű reakció sebessége a sebességegyenletben szereplő reagenskoncentráció első hatványától függ, míg a másodrendű reakció sebessége a koncentrációs tag második hatványától függ. ráta egyenlet.






