- Szerző Alex Aldridge [email protected].
- Public 2023-12-17 13:41.
- Utoljára módosítva 2025-06-01 07:36.
A legfontosabb különbség a nitrogén-monoxid és a dinitrogén-pentoxid között az, hogy a nitrogén-monoxid színtelen gáz, míg a dinitrogén-pentoxid fehér szilárd anyag.
A nitrogén-monoxid és a dinitrogén-pentoxid nitrogént és oxigént tartalmazó kémiai vegyületek. Ezek nitrogén-oxidok. Azonban eltérő kémiai és fizikai tulajdonságokkal rendelkeznek.
Mi az a nitrogén-monoxid?
A nitrogén-monoxid egy szervetlen vegyület, amelynek kémiai képlete NO. Nitrogén-oxidnak nevezzük, mivel ez egy nitrogén-oxid. Valójában szabad gyök, mert párosítatlan elektronja van. Ráadásul ez egy heteronukleáris kétatomos molekula.
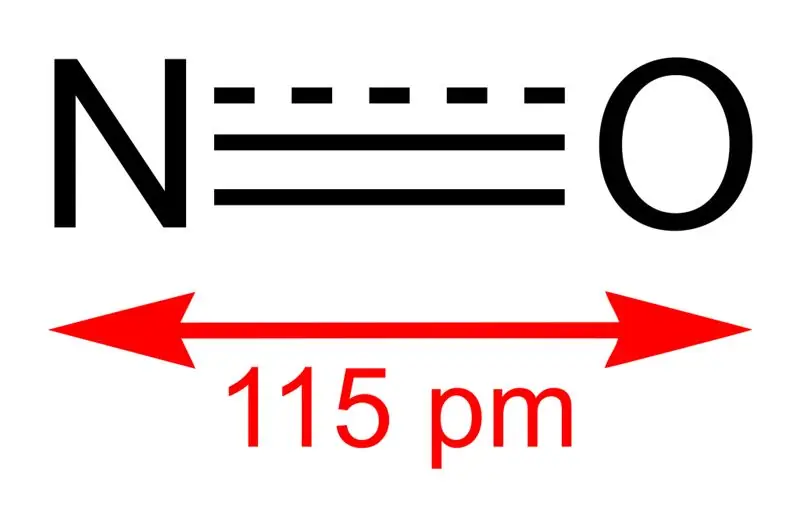
01. ábra: A nitrogén-monoxid szerkezete és az N és O közötti kötés hossza
Ennek a vegyületnek a moláris tömege 30 g/mol. Színtelen gázként fordul elő. Ezenkívül az olvadáspontja -164 °C, míg a forráspontja -152 °C, ami nagyon kicsi értékek más nitrogén-oxidokéhoz képest. Ezt a szabad gyököt ammónia oxidációjával 850 °C-on platina katalizátor jelenlétében állíthatjuk elő. Laboratóriumi méretekben azonban híg salétromsav rézzel való redukálásával is elkészíthetjük.
Mi az a dinitrogén-pentoxid?
A dinitrogén-pentoxid egy szervetlen vegyület, amelynek kémiai képlete N2O5 Nitrogén-pentoxidnak hívjuk. Ez egy bináris nitrogén-oxid. Ezenkívül instabil, és veszélyes oxidálószerként működhet. A vegyület moláris tömege 108,01 g/mol. Fehér színű szilárd anyag jelenik meg.
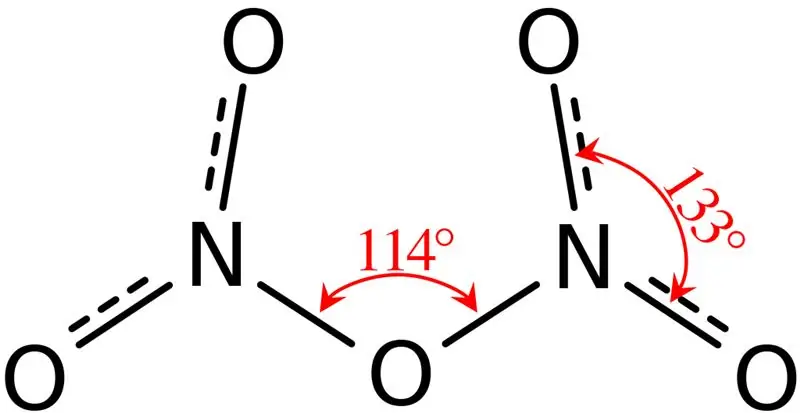
02. ábra: A dinitrogén-pentoxid szerkezete
Továbbá ennek a vegyületnek az olvadáspontja 41 °C, és 47 °C-on ez a vegyület szublimálódik. Ez a vegyület vízzel reagál, salétromsavat képezve. Ezenkívül a dinitrogén-pentoxid molekula molekula alakja sík. Ezt a vegyületet salétromsav foszfor-pentoxiddal történő dehidratálásával állíthatjuk elő.
Mi a különbség a nitrogén-monoxid és a dinitrogén-pentoxid között?
A nitrogén-monoxid egy szervetlen vegyület, amelynek kémiai képlete NO, míg a dinitrogén-pentoxid egy szervetlen vegyület, amelynek kémiai képlete N2O5 A legfontosabb különbség a nitrogén-monoxid és a dinitrogén-pentoxid között az, hogy a nitrogén-monoxid színtelen gáz, míg a dinitrogén-pentoxid fehér szilárd anyag. Ezenkívül nitrogén-monoxidot állíthatunk elő ammónia oxidációjával 850 °C-on platina katalizátor jelenlétében. A dinitrogén-pentoxidot azonban a salétromsav foszfor-pentoxiddal történő dehidratálásával állítják elő. Ha figyelembe vesszük a molekula alakját, a nitrogén-monoxid lineáris, míg a dinitrogén-pentoxid sík.
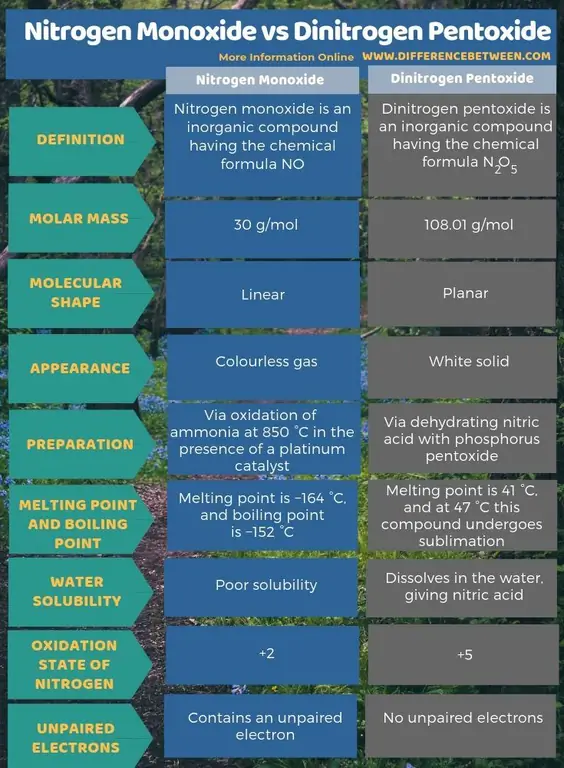
Összefoglaló - Nitrogén-monoxid kontra dinitrogén-pentoxid
A nitrogén-monoxid egy szervetlen vegyület, amelynek kémiai képlete NO, míg a dinitrogén-pentoxid egy szervetlen vegyület, amelynek kémiai képlete N2O5 A legfontosabb különbség a nitrogén-monoxid és a dinitrogén-pentoxid között az, hogy a nitrogén-monoxid színtelen gáz, míg a dinitrogén-pentoxid fehér szilárd anyag.






