- Szerző Alex Aldridge [email protected].
- Public 2023-12-17 13:41.
- Utoljára módosítva 2025-06-01 07:36.
Az alfa- és a béta-hélix közötti fő különbség a hidrogénkötések típusán múlik, amelyeket ezeknek a struktúráknak a kialakítása során alakítanak ki. Az alfa-hélixek intramolekuláris hidrogénkötéseket, míg a béta-hélixek intermolekuláris hidrogénkötéseket alkotnak.
A komplex fehérjéknek négy szerkezeti szervezeti szintje van - elsődleges, másodlagos, harmadlagos és kvaterner. A fehérjék másodlagos szerkezete különböző orientációjú peptidláncokat alkot. A peptidláncok aminosav-szekvenciákból állnak, amelyeket peptidkötések kötnek össze. Ezért a fehérjékben két fő másodlagos szerkezet található, az alfa-hélix és a béta-hélix. Ezen kívül vannak más másodlagos struktúrák is, az úgynevezett béta fordulat és hajtűszerkezetek. Ez a cikk elsősorban az alfa és a béta hélix közötti különbségre összpontosít.
Mi az Alpha Helix?
A fehérjéknek négy szervezeti szintje van. Ezek közül az alfa-hélix a fehérjék leggyakoribb másodlagos szerkezete. És ez a szerkezet egy rúdként jelenik meg, amely egy központi tengely köré van tekercselve. Továbbá az alfa hélix egy jobbkezes hélix. Azonban balkezes hélixek is jelen lehetnek. Itt a peptidkötések az amino-terminálistól a karboxi-terminálisig képződnek. Az aminosavak ezeken a peptidkötéseken keresztül kapcsolódnak egymáshoz. Az alfa-hélix kialakulásának fő oka az intramolekuláris hidrogénkötések.
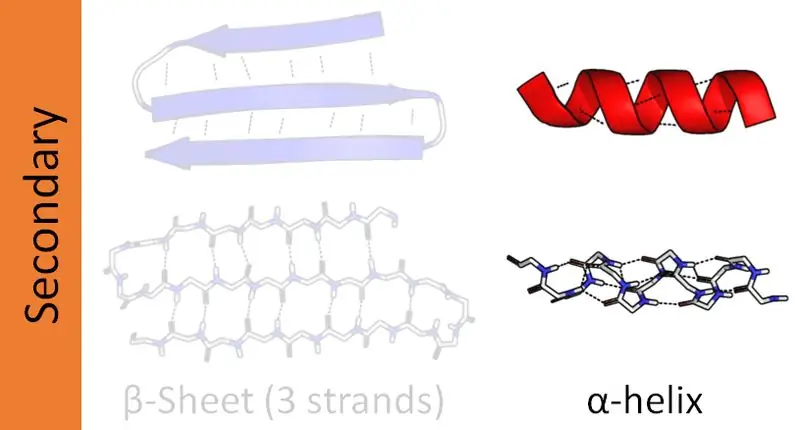
01. ábra: Alpha Helix
Az alfa hélix elrendezése a fehérje hidrofil és hidrofób természetétől függ. Ha az aminosavszekvencia nagyszámú hidrofil R (variábilis) csoportból áll, az R csoportok a vizes fázis felé orientálódnak. Ha a változó csoportok hidrofóbok, akkor kinyúlnak a környezet hidrofób fázisába. Mindkét esetben úgy tűnik, hogy az R csoportok kinyúlnak a spirális szerkezetből. Ezeknek a szerkezeti jellemzőknek köszönhetően az alfa hélix ellenállóbb a mutációkkal szemben. Így a hidrogénkötések jelenléte stabilizálja az alfa hélix szerkezetét. Egy alfa-hélixben fordulatonként átlagosan 3,6 maradék van, mivel 3,6 maradék szükséges a hidrogénkötések kialakulásához. Egyes szerkezeti fehérjék, például a kollagén és a keratin gazdag alfa-hélixekben.
Mi az a Beta Helix?
A béta hélix a fehérje második leggyakoribb másodlagos szerkezete. Bár nem olyan gyakori, mint az alfa hélix, a béta hélixek jelenléte is nagy szerepet játszik a fehérje szerkezetében. A béta-hélix kialakulása két béta-lapon keresztül megy végbe, amelyek párhuzamosan vagy anti-párhuzamos módon vannak elrendezve. Ezek a lapok ezután spirális szerkezetté alakulnak. A két lemezszál közötti intermolekuláris hidrogénkötések elősegítik a béta-hélix kialakulását.

02. ábra: Beta Helix
A béta spirálok kötési mintájuktól függően jobb- vagy balkezesek is lehetnek. A béta-hélix kialakításakor a két béta-lap változó csoportjai a hélix magjában helyezkednek el. Ezért a béta lapokat alkotó csoportok többsége hidrofób funkcióval rendelkezik.
Az alfa-hélixszel ellentétben a béta-hélixben 17 maradék alkot egy fordulatot. A fémionok képesek aktiválni a béta hélix képződését. Az alfa-hélixhez hasonlóan a hidrogénkötések támogatják a béta-hélix szerkezetének fenntartását. A szén-anhidráz enzim és a pektát-liáz két béta-hélixben gazdag fehérje.
Milyen hasonlóságok vannak az alfa és a béta helix között?
- Az alfa és a béta hélix a fehérjék két másodlagos szerkezete.
- Az aminosavak mindkét másodlagos szerkezet monomerei.
- Továbbá az alfa- és béta-hélixek kémiai összetevői szén, hidrogén, oxigén, nitrogén és kén.
- Emellett mindkét másodlagos struktúra magasabb szintű szervezetté fejlődik.
- Sőt, mindkettőt hidrogénkötések stabilizálják.
- Mindkét szerkezetben a hidrofobicitást az aminosavak R csoportjainak jelenléte határozza meg.
Mi a különbség az Alpha és a Beta Helix között?
A legfontosabb különbség az alfa- és béta-hélix között a hidrogénkötés típusa. Az alfa-hélix intramolekuláris hidrogénkötést, míg a béta-hélix intermolekuláris hidrogénkötést mutat. Ezenkívül az alfa-hélix jobbkezes hélixet, míg a béta-hélix jobb- és balkezes hélixet is alkothat. Tehát ez is jelentős különbség az alfa és a béta hélix között.
További különbség az alfa- és a béta-hélix között, hogy az alfa-hélix képződése az aminosav-szekvencia elcsavarásával megy végbe, míg a béta-hélix képződésében a két béta-lap párhuzamos vagy anti-párhuzamos módon kötődik alkotják a spirális szerkezetet.
Az alábbi infografika további információkat mutat be az alfa és a béta hélix közötti különbségről.

Összefoglaló - Alpha vs Beta Helix
Mind az alfa-, mind a béta-hélixek fontosak az összetett fehérjeszerkezetek azonosításában és levezetésében. Mindkét típus a fehérjék másodlagos szerkezete. Az alfa-hélix azonban aminosavszekvenciák spirális csavarja. Ezzel szemben a béta-hélix kialakulása párhuzamos vagy anti-párhuzamos béta-lemezek hidrogénkötésén keresztül történik. Ezenkívül a hidrogénkötés alfa-hélix formában intramolekuláris, míg a hidrogénkötés intermolekuláris béta-hélix formában. Emellett mindkét szerkezetben van egy R csoport, amely meghatározza a fehérje hidrofób jellegét. Így ez összefoglalja az alfa és a béta hélix közötti különbséget.






