- Szerző Alex Aldridge [email protected].
- Public 2023-12-17 13:41.
- Utoljára módosítva 2025-06-01 07:36.
Kiemelt különbség - erős ligandum vs gyenge ligandum
A ligandum egy atom, ion vagy molekula, amely két elektronját adományozza vagy megosztja egy koordináta kovalens kötésen keresztül egy központi atommal vagy ionnal. A ligandumok fogalmát a koordinációs kémia alatt tárgyaljuk. A ligandumok olyan kémiai anyagok, amelyek részt vesznek a fémionokkal alkotott komplexek képzésében. Ezért komplexképző szerekként is ismertek. A ligandumok lehetnek egyfogúak, kétfogúak, háromfogúak stb., a ligandum denticitása alapján. A denticitás a ligandumban jelenlévő donorcsoportok száma. Az egyfogú azt jelenti, hogy a ligandumnak csak egy donorcsoportja van. A kétfogú azt jelenti, hogy egy ligandum molekulánként két donorcsoport van. A ligandumoknak két fő típusa van a kristálytérelmélet alapján kategorizálva; erős ligandumok (vagy erős mező ligandumok) és gyenge ligandumok (vagy gyenge mező ligandumok). A legfontosabb különbség az erős ligandumok és a gyenge ligandumok között az, hogy az orbiták felhasadása egy erős térerős ligandumhoz való kötődés után nagyobb különbséget okoz a magasabb és az alacsonyabb energiaszintű pályák között, míg a pályák felhasadása egy gyenge térerejű ligandumhoz való kötődés után kisebb különbséget okoz. a magasabb és alacsonyabb energiaszintű pályák között.
Mi az a kristálymező elmélet?
A kristálytérelmélet olyan modellként írható le, amelyet arra terveztek, hogy megmagyarázza az elektronpályák (általában d vagy f pályák) degenerációit (egyenlő energiájú elektronhéjak) a környezet által keltett statikus elektromos tér miatt. anion vagy anionok (vagy ligandumok). Ezt az elméletet gyakran használják átmenetifém-ionkomplexek viselkedésének bemutatására. Ez az elmélet megmagyarázhatja a mágneses tulajdonságokat, a koordinációs komplexek színeit, a hidratációs entalpiákat stb.
Elmélet:
A fémion és a ligandumok közötti kölcsönhatás a pozitív töltésű fémion és a ligandum páratlan elektronjainak negatív töltése közötti vonzás eredménye. Ez az elmélet főként az öt degenerált elektronpályán végbemenő változásokon alapul (egy fématomnak öt d pályája van). Amikor egy ligandum közel kerül a fémionhoz, a párosítatlan elektronok közelebb vannak néhány d pályához, mint a fémion más d pályáihoz. Ez a degeneráció elvesztését okozza. Ezenkívül a d pályákon lévő elektronok taszítják a ligandum elektronjait (mivel mindkettő negatív töltésű). Ezért a ligandumhoz közelebb eső d pályák energiája nagyobb, mint a többi d pályáé. Ez azt eredményezi, hogy a d pályák az energia alapján nagy energiájú d pályákra és alacsony energiájú d pályákra osztódnak.
Egyes tényezők befolyásolják ezt a felosztást: a fémion természete, a fémion oxidációs állapota, a ligandumok elrendezése a központi fémion körül és a ligandumok természete. Ezeknek a d pályáknak az energia alapján történő felosztása után a nagy és alacsony energiájú d pályák közötti különbséget kristálymező hasítási paraméterként ismerjük (∆oct oktaéder komplexek esetén).
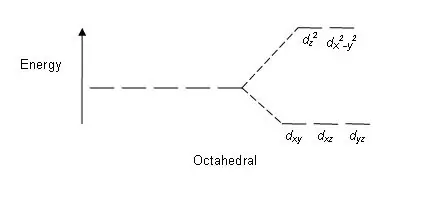
01. ábra: Hasítási minta oktaéderes komplexumokban
Felosztási minta: Mivel öt d pálya van, a felosztás 2:3 arányban történik. Az oktaéderes komplexumokban két pálya van a magas energiaszinten (együttesen „pl”), és három orbitál az alacsonyabb energiaszinten (együttesen t2g néven ismert). A tetraéderes komplexekben ennek az ellenkezője történik; három pálya van a magasabb energiaszinten, kettő pedig az alacsonyabb energiaszinten.
Mi az erős ligandum?
Egy erős ligandum vagy egy erős mező ligandum olyan ligandum, amely nagyobb kristálytérhasadást eredményezhet. Ez azt jelenti, hogy egy erős mező ligandum kötődése nagyobb különbséget okoz a magasabb és alacsonyabb energiaszintű pályák között. Példák: CN- (cianid ligandumok), NO2- (nitroligandum) és CO (karbonil) ligandumok).
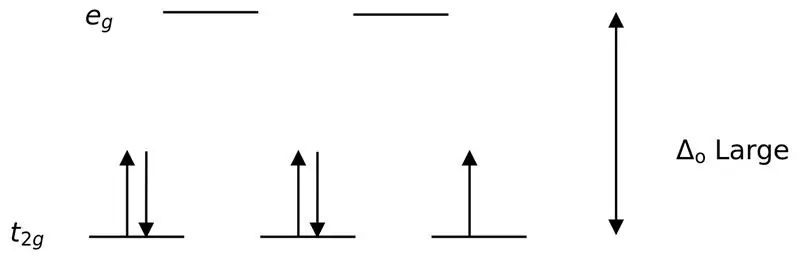
02. ábra: Alacsony centrifugálású hasítás
Ezekkel a ligandumokkal alkotott komplexek kialakítása során először az alacsonyabb energiájú pályák (t2g) teljesen megtelnek elektronokkal, mielőtt bármely más magas energiaszintű pályára (pl.) megtelnének. Az így képződött komplexeket „alacsony spinű komplexeknek” nevezzük.
Mi az a gyenge ligandum?
A gyenge ligandum vagy a gyenge térerejű ligandum olyan ligandum, amely alacsonyabb kristálymező hasadást eredményezhet. Ez azt jelenti, hogy egy gyenge térerejű ligandum kötődése kisebb különbséget okoz a magasabb és alacsonyabb energiaszintű pályák között.
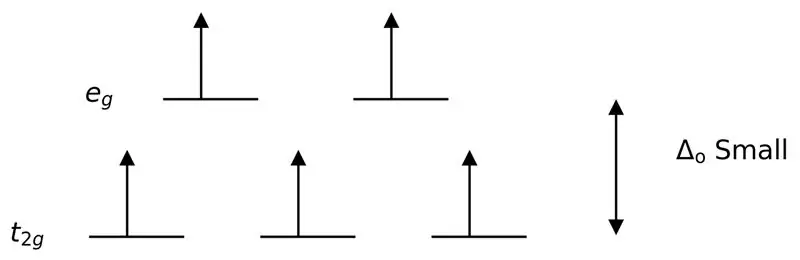
3. ábra: Magas spinű felosztás
Ebben az esetben, mivel a két pályaszint közötti kis különbség taszítást okoz az elektronok között ezeken az energiaszinteken, a magasabb energiájú pályák könnyen megtölthetők elektronokkal, mint az alacsony energiájú pályákon. Az ezekkel a ligandumokkal képződött komplexeket „nagy spinű komplexeknek” nevezik. Gyenge mező ligandumok például az I- (jodid ligandum), Br- (bromid ligandum), stb.
Mi a különbség az erős ligandum és a gyenge ligandum között?
Erős ligand vs gyenge ligand |
|
| Az erős ligandum vagy az erős térerős ligandum olyan ligandum, amely nagyobb kristálymező-hasadást eredményezhet. | A gyenge ligandum vagy a gyenge térerejű ligandum olyan ligandum, amely alacsonyabb kristálymező hasadását eredményezheti. |
| Elmélet | |
| Az erős mező ligandum megkötése utáni hasadás nagyobb különbséget okoz a magasabb és az alacsonyabb energiaszintű pályák között. | A pályák kettéválása egy gyenge térerejű ligandum megkötése után kisebb különbséget okoz a magasabb és alacsonyabb energiaszintű pályák között. |
| Kategória | |
| Az erős mező ligandumokkal képzett komplexeket „alacsony spinű komplexeknek” nevezik. | A gyenge térerejű ligandumokkal képződött komplexeket „nagy spinű komplexeknek” nevezik. |
Összefoglaló - Erős ligand vs gyenge ligand
Az erős ligandumok és a gyenge ligandumok olyan anionok vagy molekulák, amelyek a fémionok d pályáinak két energiaszintre történő felosztását okozzák. Az erős ligandumok és a gyenge ligandumok közötti különbség az, hogy az erős térerős ligandum megkötése utáni hasadás nagyobb különbséget okoz a magasabb és alacsonyabb energiaszintű pályák között, míg a pályák felhasadása egy gyenge térerejű ligandum kötődése után kisebb különbséget okoz a magasabb és alacsonyabb energiaszintű pályák között. energiaszintű pályák.






